Der Darm eines Erwachsenen beherbergt eine Vielzahl verschiedener Bakterienarten, die sich hauptsächlich im unteren Teil des Darms aufhalten und eine Symbiose mit dem menschlichen Lebensraum eingehen. In verschiedenen Studien wird heute beschrieben, wie die Darmmikrobiota mit der Haut als einem der Hauptregulatoren der Darm-Haut-Achse kommuniziert. Hauptsächlich wird untersucht wie diese potenzielle Verbindung die Hautdifferenzierung und Keratinisierung beeinflusst. Weitere Faktoren sind der Einfluss auf die Modulation der kutanen Immunantwort bei verschiedenen Krankheiten und schließlich wie man sich diese Kommunikation bei der Kontrolle verschiedener Hautkrankheiten zunutze machen kann.
Der Darm und die Haut, als dicht vaskularisierte und reich innervierte Organe mit entscheidenden immunologischen und neuroendokrinen Rollen, sind in einzigartiger Weise in Zweck und Funktion verwandt (1). Als unsere primäre Schnittstelle zur äußeren Umgebung sind beide Organe für die Aufrechterhaltung der physiologischen Homöostase von großer Bedeutung. Verschiedene Untersuchungen haben eine enge, bidirektionale Verbindung zwischen Darm und Haut gezeigt, und zahlreiche Studien verbinden die gastrointestinale (GI) Gesundheit mit der Homöostase und Allostase der Haut (1,2). Gastrointestinale Störungen werden oft von kutanen Manifestationen z.B. unreiner Haut oder Hautausschlag begleitet und das GI-System, insbesondere die Darmmikrobiota, scheint an der Pathophysiologie vieler entzündlicher Erkrankungen beteiligt zu sein (3, 4, 5). Hautkrankheiten, die am häufigsten mit einem gestörten Gleichgewicht der Darmmikrobiota zusammenhängen sind Akne, Neurodermitis und Schuppenflechte (Psoriasis) (Abb. 1).
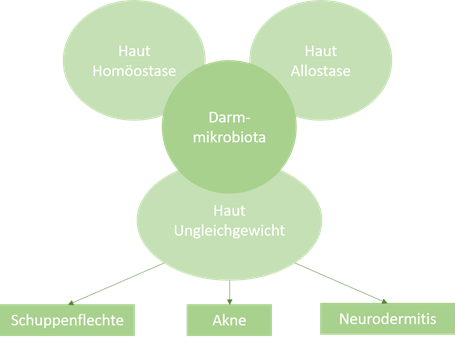
Abb. 1: Die Darm-Haut-Achse: Zusammenhang von Haut, Darm und Hautkrankheiten
Der Einfluss der Darmmikrobiota auf die Homöostase und die Allostase der Haut
Die Haut hat drei Hauptfunktionen – Schutz vor Außeneinwirkung, Temperaturregulierung und Wasserspeicherung. Diese und mehr Funktionen kann sie aber nur im Zustand der Homöostase (Gleichgewicht) erfüllen. Als ein Organ, das sich ständig erneuert, ist ein effektiver epidermaler Prozess, durch den sich die Haut selbst regeneriert, für die Aufrechterhaltung dieses Zustands unerlässlich. Epidermale Zellen entstehen aus Stammzellen in der Basalschicht der Epidermis und durchlaufen dann morphologische Veränderungen, während sie an die Hautoberfläche gelangen. Die Zellen differenzieren sich in drei Zelltypen – Basalzellen, Stachelzellen und Körnerzellen – bevor sie schließlich zu den Korneozyten, die die äußerste Schicht der Epidermis bilden, werden. Dieser Prozess der epidermalen Differenzierung, auch als Keratinisierung bezeichnet, steht unter der Kontrolle von speziellen Transkriptionsprogrammen (6,7, 8, 9). Letztlich führt dieser hochregulierte Prozess zur äußersten Hautschicht, dem Stratum corneum, das aus etwa 15 Schichten dicht keratinisierter Korneozyten, die durch mehrere Lipid Doppelschichten in einem “Ziegelstein- und Mörtel”-Modell zusammengehalten werden besteht. Die Korneozyten dienen als Ziegelsteine, während Ceramide, Cholesterin, Fettsäuren und Cholesterinester den Mörtel bilden, der die Ziegelsteine zusammenhält. Wenn der epidermale Umsatz angemessen funktioniert, dient die resultierende Ziegelstein- und Mörtelstruktur als effektive Hautbarriere mit der Fähigkeit, die Verdunstung zu begrenzen, die Feuchtigkeit zu bewahren und die Haut vor dem Eindringen fremder Organismen und Substanzen zu schützen (6, 7, 8). Durch ihren Einfluss auf die Signalwege die diesen für die Hauthomöostase wichtigen Prozess koordinieren, beeinflusst die Darmmikrobiota die Hautgesundheit (1).
Die intestinale Mikrobiota trägt auch zur Allostase der Haut, der Wiederherstellung der Homöostase nach einer Störung oder einem Stressor, durch Darm-Mikrobiota-vermittelte Effekte auf die angeborene und adaptive Immunität bei (10, 11, 12). Studien haben gezeigt, dass Darmbakterien die Reaktion auf eine gestörte Barrierefunktion der Haut positiv beeinflussen können. Zum Beispiel konnten Baba et al. (2010) zeigen, dass die Verabreichung von Lactobacillus helveticus den Schweregrad einer Natriumdodecylsulfat-induzierten Dermatitis verringern kann. Eine andere Studie zeigte eine verbesserte Wiederherstellung der Hautbarrierefunktion.
Intestinale Dysbiose und Hautkrankheiten
Intestinale Dysbiose, ein Zustand des mikrobiellen Ungleichgewichts im Darm, hat das Potenzial, die Hautfunktion negativ zu beeinflussen. Freies Phenol und p-Kresol, Stoffwechselprodukte von aromatischen Aminosäuren, werden als Biomarker für ein gestörtes Darmmilieu verwendet, da ihre Produktion durch bestimmte pathogene Bakterien induziert wird, vor allem durch Clostridium difficile. Diese Metabolite können in den Stoffwechsel gelangen, wobei sie sich bevorzugt in der Haut anreichern und die Differenzierung der Epidermis und die Integrität der Hautbarriere beeinträchtigen können (1). Besonders hohe p-Kresol-Serumspiegel werden mit einer verminderten Hautfeuchtigkeit und einer gestörten Keratinisierung assoziiert (13, 14). Eine intestinale Dysbiose führt zu einer erhöhten epithelialen Permeabilität, die dann die Aktivierung von Effektor-T-Zellen auslöst und deren Gleichgewicht mit immunsuppressiven regulatorischen T-Zellen zerstört. Pro-inflammatorische Zytokine erhöhen die epitheliale Permeabilität weiter und setzen einen Teufelskreis der chronischen systemischen Entzündung in Gang (1, 15). Dies sind nur einige der Mechanismen durch die sich eine gestörte Darmmikrobiota in einer beeinträchtigten Hautfunktion zeigt. Zu den drei häufigsten Auswirkungen einer intestinalen Dysbiose zählen Akne, Neurodermitis und Schuppenflechte.
Behandlung und Prävention einer intestinalen Dysbiose
Die Darmmikrobiota wird stark von der Ernährung beeinflusst. Obwohl langfristige Ernährungsgewohnheiten die bakterielle Zusammensetzung prägen, kann eine dramatische Modulation der Ernährung über einen kurzen Zeitraum schnell andere unerwünschte „Darmbewohner“ hervorbringen. Angesichts des Einflusses der Darmmikrobiota auf die Entstehung von Entzündungskrankheiten bietet dies die Möglichkeit, die Mikrobiota gezielt mit therapeutischen Mitteln zu modifizieren (16).
Möglichkeiten sind z.B. eine probiotische Supplementierung, die Verabreichung von lebenden nützlichen Darmbakterien. Der Einsatz von Probiotika konnte bereits vielversprechende Erfolge bei der Prävention und Behandlung verschiedener Erkrankungen zeigen (17, 18, 19, 20, 21, 22).
Besonders erfolgreich konnte sich der Einsatz von Probiotika bei der Behandlung von Akne zeigen. Bestimmte Stämme können das Bakterium Propionibacterium acnes, welches unter anderem für Akneausbrüche verantwortlich ist, unterdrücken. Durch das Absondern eines antibakteriellen Proteins wird das Wachstum dieses Bakteriums gehemmt (25).
Es gibt natürlich viele Bakterienstämme, die als Probiotika erhältlich sind, aber die wichtigsten, die im Zusammenhang mit der Hautgesundheit in Betracht gezogen werden sollten, sind Lactobacillus-Arten und Bifidobacterium. In einer kürzlich durchgeführten Humanstudie wurde nach einer 12-wöchigen oralen Supplementierung mit Lactobacillus brevis ein signifikanter Rückgang des Wasserverlustes über die Hautepidermis und eine erhöhte Hauthydratation beobachtet [9]. Eine andere Studie zeigte ebenfalls eine deutliche Verbesserung der Hautelastizität und eine erhöhte Hautfeuchtigkeit nach 12 Wochen oraler Supplementierung mit Lactobacillus plantarum (25).
Die Ernährung ist weithin als ein Schlüsselfaktor anerkannt, der die Funktion des gastrointestinalen Mikrobioms vermittelt. Ballaststoffe durchlaufen im GI-Trakt einen Prozess der bakteriellen Fermentation, wobei kurzkettige Fettsäuren entstehen, die einen gesunden Dickdarm fördern. Kurzkettige Fettsäuren (SCFA) können das Wachstum bestimmter Hautmikroben fördern, die die Immunabwehr beeinflussen und das Entzündungspotential der Haut regulieren (25). Studien haben gezeigt, dass eine höhere Ballaststoffzufuhr mit einer erhöhten Darmmikroben-Diversität verbunden ist, und eine ausgeprägte Diversität der Bakterienstämme im Darm ist entscheidend für die Darm- und damit auch die Hautgesundheit (25).
Autorin: Laura Ingenlath, Quality Manager, Taiyo GmbH.
Der Original-Artikel ist erschienen in der “Vitalstoffe 2/2021”, BK nutri network, Juni 2021.
Wenn Sie Fragen zur Darm-Haut-Achse und zu Taiyos Ballaststoff Sunfiber® haben, der eine höhere Darmmikroben-Diversität unterstützt, dann zögern Sie nicht uns zu kontaktieren!
Referenzen:
- O’Neill, C. A., Monteleone, G., McLaughlin, J. T., and Paus, R. (2016). The gut-skin axis in health and disease: a paradigm with therapeutic implications. Bioessays 38, 1167–1176. doi: 10.1002/bies.201600008
- Levkovich, T., Poutahidis, T., Smillie, C., Varian, B. J., Ibrahim, Y. M., Lakritz, J. R., et al. (2013). Probiotic bacteria induce a ‘glow of health’. PLoS One 8:e53867. doi: 10.1371/journal.pone.0053867
- Shah, K. R., Boland, C. R., Patel, M., Thrash, B., and Menter, A. (2013). Cutaneous manifestations of gastrointestinal disease: part I. JAAD 68, 189.e1-189.e21. doi: 10.1016/j.jaad.2012.10.037
- Thrash, B., Patel, M., Shah, K. R., Boland, C. R., and Menter, A. (2013). Cutaneous manifestations of gastrointestinal disease: part II. JAAD 68, 211.e1-211.e33. doi: 10.1016/j.jaad.2012.10.036
- Gloster, H. M., Gebauer, L. E., and Mistur, R. L. (2016). “Cutaneous manifestations of gastrointestinal disease,” in Absolute Dermatology Review, eds H. M. Gloster, L. E. Gebauer, and R. L. Mistur (Cham: springer), doi: 10.1007/978-3-319-03218-4_48
- Baba, H., Masuyama, A., and Yoshimura, C. (2012). Promoter of differentiation and keratinization of epidermic cell and functional beverage/food for promotion of keratinization of epidermis. U.S. Patent NO CA2614111A1
- Weaver, C. T., Elson, C. O., Fouser, L. A., and Kolls, J. K. (2013). The Th17 pathway and inflammatory diseases of the intestines, lungs, and skin. Annu. Rev. Pathol. 24, 477–512. doi: 10.1146/annurev-pathol-011110-130318
- Gaur, M., Dobke, M., and Lunyak, V. V. (2014). Mesenchymal stem cells from adipose tissue in clinical applications for dermatological indications and skin aging. Int. J. Mol. Sci. 18:208. doi: 10.3390/ijms18010208
- Abhishek, S., Tech, M., and Krishnan, S. P. (2016). Epidermal differentiation complex: a review on its epigenetic regulation and potential drug targets. Cell J. 18, 1–6. doi: 10.22074/cellj.2016.3980
- Benyacoub, J., Bosco, N., Blanchard, C., Demont, A., Philippe, D., CastielHigounenc, I., et al. (2014). Immune modulation property of Lactobacillus paracasei NCC2461 (ST11) strain and impact on skin defences. Benef. Microbes 5, 129–136. doi: 10.3920/BM2013.0014
- Kim, H. M., Lee, D. E., Park, S. D., Kim, Y., Kim, Y. J., Jeong, J. W., et al. (2014). Oral administration of Lactobacillus plantarum HY7714 protects hairless mouse against ultraviolet B-induced photoaging. J. Microbiol. Biotechnol. 24, 1583–1591. Doi:10.4014/jmb.1406.06038
- Chen, Y., Wu, C., Chao, Y., Lin, C., Tsai, H., Li, Y., et al. (2017). Lactobacillus pentosus GMNL-77 inhibits skin lesions in imiquimod-induced psoriasis-like mice. J. Food Drug Anal. 25, 559–566. doi: 10.1016/j.jfda.2016. 06.003
- Dawson, L. F., Donahue, E. H., Cartman, S. T., Barton, R. H., Bundy, J., McNerney, R., et al. (2011). The analysis of para-cresol production and tolerance in Clostridium difficile 027 and 012 strains. BMC Microbiol. 11:86. doi: 10.1186/1471-2180-11-86
- Miyazaki, K., Masuoka, N., Kano, M., and Iizuka, R. (2014). Bifidobacterium fermented milk and galacto-oligosaccharides lead to improved skin health by decreasing phenols production by gut microbiota. Benef. Microbes 5, 121–128. doi: 10.3920/BM2012.0066
- Kosiewicz, M. M., Dryden, G. W., Chhabra, A., and Alard, P. (2014). Relationship between gut microbiota and development of T cell associated disease. FEBS Lett. 588, 4195–4206. doi: 10.1016/j.febslet.2014.03.019
- Huang, Y. J., Marsland, B. J., Bunyavanich, S., O’Mahoney, L., Leung, D. Y. M., Muraro, A., et al. (2017). The microbiome in allergic disease: current understanding and future opportunities – 2017 PRACTALL document of the American Academy of Allergy, Asthma & Immunology and the European Academy of Allergy and Clinical Immunology. J. Allergy Clin. Immunol. 139, 1099–1110. Doi:10.1016/j.jaci.2017.02.007
- Krutmann, J. (2009). Pre-and probiotics for human skin. J. Dermatol. Sci. 54, 1–5. doi: 10.1016/j.jdermsci.2009.01.002
- Hill, C., Guarner, F., Reid, G., Gibson, G. R., Merenstein, D. J., Pot, B., et al. (2014). Expert consensus document: the International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nat. Rev. Gastroenterol. Hepatol. 11, 506–514. doi: 10.1038/nrgastro.2014.66
- Farris, P. K. (2016). Are skincare Products with probiotics worth the hype? Dermatology Times, 8th, August
- Grant, M. C., and Baker, J. S. (2017). An overview of the effect of probiotics and exercise on mood and associated health conditions. Crit. Rev. Food Sci. Nutr. 57, 3887–3893. Doi: 10.1080/10408398.2016.1189872Sánchez
et al., 2017
- Sarao, L. K., and Arora, M. (2017). Probiotics, prebiotics, and microencapsulation: a review. Crit. Rev. Food Sci. Nutr. 57, 344–371. doi: 10.1080/10408398.2014
. 887055
- Muizzuddin, N., Maher, W., Sullivan, M., Schnittger, S., and Mammone, T. (2012). Physiological effect of a probiotic on skin. J. Cosmet. Sci. 63, 385–395
- Frei, R., Akdis, M., and O’Mahony, L. (2015). Prebiotics, probiotics, synbiotics, and the immune system: experimental data and clinical evidence. Curr. Opin. Gastroenterol. 31, 153–158. doi: 10.1097/MOG.0000000000000151
- Salem, I. Ramser, A. Ghannoum, MA. (2018). ‘The Gut Microbiome as a Major Regulator of the Gut-Skin Axis’, Frontiers in Microbiology, (9), pp.1459. Zugriff am 31.05.2021. Verfügbar unter https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6048199/
#!po=2.77778
- Holscher, HD. (2017). ‘Dietary fiber and prebiotics and the gastrointestinal microbiota’, Gut Microbes, 8 (2), pp. 172-184. Zugriff am 31.05.2021. Verfügbar unter https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5390821/
Bildquelle: Shutterstock | Rido






